A alergia alimentar, também denominada hipersensibilidade alimentar ou dermatite trofo-alérgica, ocorre em 10% dos cães e gatos dermatopatas e corresponde a cerca de 5% dos casos alérgicos, consituindo-se como a terceria dermatopatia de natureza alérgica mais frequente dentre cães e gatos.
A patogenia deste quadro envolve reações de hipersensibilidade tipos II, III e IV a antígenos alimentares, normalmente representados por glicoproteínas.
Estes antígenos são macromoléculas protéicas hidrosolúveis, com peso molecular superior a 7500 daltons, absorvidos pela mucosa intestinal devido a falhas na barreira intestinal, e reconhecidos como antígenos devido a falhas no sistema imunológico. A barreira intestinal é constituída pela secreção de Ig A de mucosa, pelas células epiteliais fortemente unidas e pela presença de muco.
Dentre os alimentos identificados como alergenos podemos citar: carne bovina, soja, frango, leite, milho, trigo e conservantes. Estes passam a serem reconhecidos com antígenos após a cocção, preparo e digestão do alimento.
Os animais podem ser acometidos em qualquer idade, sendo que cerca de 50% dos casos são animais jovens, menores de 1 ano. Mesmo quando o alimento, quer de origem comercial ou caseira, é oferecido há muito tempo para determinado animal , sem ter havido qualquer mudança nos hábitos aliementares, devemos suspeitar de alergia aliementar, pois a primo-manifestação dos sintomas pode demorar meses a anos.
Dentre as raças caninas mais predispostas podemos citar o Cocker Spaniel, o Labrador, o Collie, o Schnauzer, o Shar Pei, o Poodle, o West Highland, o Boxer, o Lhasa Apso e o Teckel.
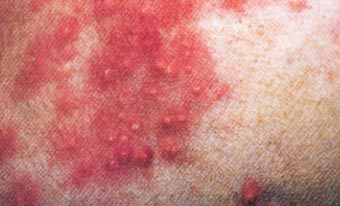
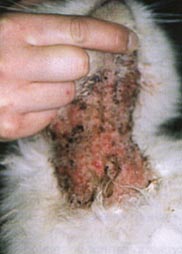
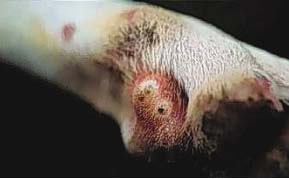
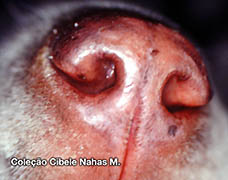
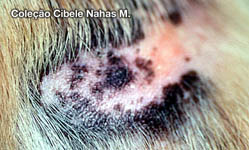
Os sintomas da alergia alimentar são prurido intenso , mormente em região de face, orelhas, axilas, porções ventrais do corpo e membros. Podem estar presentes malasseziose cutânea e piodermites secundárias, bem como otites externas. As disqueratoses acompanham grande parte dos casos. Em cerca de 10 a 15% dos cães com dermatite trofo-alérgica há concomitância com emese, diarréia e cólicas intestinais intermitentes.
As lesões incluem alopecia focal ou disseminada, eritema, pápulas, pústulas, crostas , hiperqueratose ou liquenificação, descamação, untuosidade ou ressecamento cutâneo.
No gatos a alergia alimentar pode se manifestar clinicamente de múltiplas formas: dermattie miliar, alopecia, prurido (principalmente facial e cervical), urticária, granuloma eosinfílico (placa eosinofílcia, úlcera indolente e granuloma linear). Cerca de 10% dos felinos também apresentam emese e diarréia.
Não há sazonalidade quanto às manifestações sintomatológicas, exceto naqueles casos em que há associação com dermatite atópica.
O diangnóstico da alergia alimentar pode ser firmado, única e exclusivamente, através da interposição de uma dieta caseira dita “de eliminação”, durante um período que varia entre 10 a 13 semanas. Esta dieta deve conter ingredientes jamais ingeridos anteriormente pelo animal, tais como: peixe, carneiro, coelho, carnes de caça, arroz integral, ovos, batata e outros tubérculos. Durante este período de teste não deve ser dado nada extra ao animal, como petiscos, ossos industrializados, etc.
O uso de dietas comerciais, ditas hipoalergênicas, não é indicado com finalidade diagnóstica, uma vez que há riscos de contaminação da ração com outros ingredientes durante o processo de industrialização, ao fato de que a fonte de gordura animal contida na ração poder conter proteínas estranhas e, sobretudo, à presença de conservantes e aditivos, aos quais os animais podem ser alérgicos.
Vários estudos conduzidos por pesquisadores nos EUA mostram que 15 a 50% dos cães comprovadamente alérgicos a alimentos apresentam alergia a rações comerciais ditas hipoalergênicas.
Havendo uma melhora significativa após o término deste período de teste, pode-se optar pela exposição provocativa, em que o alimento ao qual se deseja investig é introduzido na dieta caseira de eliminação a cada 14 dias, observando-se neste período a piora ou manutenção do quadro. Quando houver agravamento lesional e recidiva do prurido, aquele alimento testado é considerado como alergeno e eliminado da dieta daquele animal. Assim, pode-se chegar à conclusão de que alimentos estão envolvidos na etiopatogenia da alergia para cada animal, e propor dietas caseiras balanceadas e individualizadas, ou mesmo dietas comerciais que não os contenham.
Muitos proprietários preferem manter a dieta de aliminação “ad eternum”, pois julgam ser menos trabalhoso ou porque temerem a recidiva dos sintomas e lesões. Neste caso, deve-se realizar um balanceamento correto da dieta, e ter em mente que este animal poderá se tornar também alérgico a estes ingredientes, no futuro.
Os testes sosrológicos e cutâneos não são indicados para o diagnóstico da hipersensibilidade alimentar, por vários motivos: primeiramente, por avaliarem apenas uma reação de hieprsensibilidade do tipo I, que não está envolvida na etipatogenia deste quadro . Ainda, utilizam antígenos “in natura”, ou seja, não processados ou submetidos à cocção, industrialização e digestão, processo estes que modificam sua estrutura molecular. Por fim, estes testes apresentam baixa especificidade e não são métodos confiáveis.
O tratamento envolve a idnetificação dos alergenos envolvidos e eliminação dos mesmos da dieta, utilizando-se preparados caseiros formulados de acordo com o resultado da exposição provocativa, ou rações comerciais que não contenham os alergenos em questão. A relação ideal entre carbohidratos e proteínas da dieta é de 1:1, desde que não haja nefropatia ou hepatopatia concomitante. O carbonato de cálcio deve ser acrescido, bem como vitminas, ácidos graxos e sais minerais. Para tanto, pode-se lançar mão do balanceamento nutriconal elaborado com auxílio de planilhas nutricionais ou de profissionais especialistas nesta área.
O uso de drogas anti-pruriginosas, tais como anti-histamíncios e glicocorticóides, podem ser usados para aliviar o prurido durante a fase inicial da dieta, mas por um período breve (10 a 15 dias) , a fim de não mascarar o efeito da dieta na melhora clínica.
Os quadros cutâneos associados à hipersensibilidade, tais como Malasseziose, piodermites e disqueratose, bem como as otites, devem ser medicados em paralelo, topica ou sistemicamente, de acordo com a magnitude lesional.
O prognóstico é bom, embora sujeito a recidivas em função de novos alergenos alimentares em potencial, presentes na dieta.
Informações resumidas sobre a doença.
Cibele Nahas Mazzei, MV, MSc
dermatopet.com.br
 Alguns autores suspeitam que a origem deste defeito na renovação epidérmica e da resposta exacerbada à Malassezia, tenha uma origem genética e hereditária, determinada por uma herança recessiva autossômica ainda não identificada. Porém, há controvérsias neste ponto, pois alguns pesquisadores observaram que cães Westies com diagnóstico de displasia epidérmica, obtido mediante exame histopatológico de biópsia cutânea, que foram tratados com xampus desengordurastes e antifúngicos, bem como antifúngico e antibiótico orais, mostraram uma melhora acentuada do quadro clínico e, no novo exame dermato-histopatológico de espécimes colhidas 4 meses após o início do tratamento, houve uma mudança no padrão histológico, para o de uma dermatite perivascular superficial. Estes achados permitiram concluir que a displasia epidérmica é uma ração inflamatória de hipersensibilidade cutânea à antígenos da Malassezia sp, ou ainda resultado de um excessivo auto-traumatismo, e não uma distúrbio congênito de queratinização.
Alguns autores suspeitam que a origem deste defeito na renovação epidérmica e da resposta exacerbada à Malassezia, tenha uma origem genética e hereditária, determinada por uma herança recessiva autossômica ainda não identificada. Porém, há controvérsias neste ponto, pois alguns pesquisadores observaram que cães Westies com diagnóstico de displasia epidérmica, obtido mediante exame histopatológico de biópsia cutânea, que foram tratados com xampus desengordurastes e antifúngicos, bem como antifúngico e antibiótico orais, mostraram uma melhora acentuada do quadro clínico e, no novo exame dermato-histopatológico de espécimes colhidas 4 meses após o início do tratamento, houve uma mudança no padrão histológico, para o de uma dermatite perivascular superficial. Estes achados permitiram concluir que a displasia epidérmica é uma ração inflamatória de hipersensibilidade cutânea à antígenos da Malassezia sp, ou ainda resultado de um excessivo auto-traumatismo, e não uma distúrbio congênito de queratinização. - Dê preferência por comprar um filhote diretamente do canil ou do criador, pois é uma oportunidade de se conhecer os pais, os irmãos da mesma ninhada ou de ninhadas anteriores, e observar as condições de higiene e manejo do local (alimentação, tipo de canil, estado nutricional ds animais, etc).
- Dê preferência por comprar um filhote diretamente do canil ou do criador, pois é uma oportunidade de se conhecer os pais, os irmãos da mesma ninhada ou de ninhadas anteriores, e observar as condições de higiene e manejo do local (alimentação, tipo de canil, estado nutricional ds animais, etc).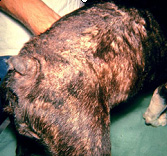










Nenhum comentário:
Postar um comentário